研究成果のポイント
- タンパク質 SNAP23※1がインスリン分泌を阻害していることを発見し、SNAP23の機能を阻害するとインスリン※2分泌が増加することを確認。
- これまでSNAP23はホルモンの放出を促進すると考えられていたが、生体内での分泌過程における詳細な機能は不明だった。
- 既存の糖尿病治療薬とは作用の異なる、SNAP23を標的とした新たな治療薬の開発が期待できる。
概要
國井政孝助教、原田彰宏教授(大阪大学 大学院医学系研究科 細胞生物学・群馬大学 生体調節研究所)、根本知己教授(北海道大学 電子科学研究所)らの研究グループは、マウス生体内において、ホルモンの放出を調節するタンパク質 SNAP23 が、膵臓ランゲルハンス島のベータ細胞からのインスリン分泌を阻害していることを明らかにしました。
これまで SNAP23 は、様々な細胞においてホルモンや酵素などの分泌を促進すると考えられていましたが、生体内における機能については解明されていませんでした。
今回、SNAP23 遺伝子を欠損したマウスを解析することにより、SNAP23 が膵臓腺房細胞からのアミラーゼ※3分泌を促進する一方、ランゲルハンス島ベータ細胞からのインスリン分泌は阻害していることを発見しました。さらに、長田裕之 グループディレクター(理化学研究所環境資源科学研究センター ケミカルバイオロジー研究グループ)らと共同で、SNAP23 の機能を阻害する低分子化合物 MF286 を同定し、その化合物がインスリン分泌を増加させる効果があることを明らかにしました。これにより、SNAP23 を標的とした新規の糖尿病治療薬の開発が期待されます。
本研究成果は、米国科学誌「The Journal of Cell Biology」に、10月3日(月)22時(日本時間)に公開されます。
本件に関して、9月28日(水)11時から大阪大学医学系研究科共通棟3階中会議室(吹田キャンパス)にて記者発表を行います。是非とも取材の程、よろしくお願い申し上げます。
研究の背景
膵臓は、消化酵素を分泌する腺房細胞からなる外分泌組織と、インスリンなどのホルモンを分泌する内分泌組織(ランゲルハンス島)の2つの組織が混在する臓器です。それぞれの組織の細胞内で合成された消化酵素やホルモンは、輸送小胞と呼ばれる袋に入って細胞膜付近へ運ばれ、開口放出※4という機構によって細胞外へ分泌されます。この開口放出は SNARE タンパク質※5によって調節されていることが知られています。細胞膜に存在するシンタキシンとSNAP、輸送小胞に存在する VAMP という3つのタンパク質が結合することによって SNARE 複合体を形成し、輸送小胞と細胞膜の融合が生じると考えられています。SNARE タンパク質の一つである SNAP23 は、全身の様々な組織で発現しており、これまでの培養細胞を用いた実験結果から、様々な細胞においてホルモンや酵素などの分泌を促進すると考えられていました。しかし、SNAP23 が生体内においてはどのように機能するのかは明らかではありませんでした。
そこで、原田教授らの研究グループでは、膵臓の腺房細胞(外分泌組織)とランゲルハンス島ベータ細胞(内分泌組織)のそれぞれの部分で SNAP23 遺伝子を欠損した(ノックアウト)マウスを作製し、SNAP23 の働きを調べました。
本研究の成果
膵臓の腺房細胞とランゲルハンス島ベータ細胞のそれぞれで特異的に SNAP23 遺伝子を欠損するマウスの作製に成功し、それぞれの膵臓の機能を解析しました。その結果、腺房細胞での SNAP23 欠損マウスではアミラーゼ分泌が著しく減少しましたが、ベータ細胞での SNAP23 欠損マウスでは逆にインスリン分泌が2倍以上に増加することがわかりました。このことから、SNAP23 が腺房細胞からのアミラーゼ分泌には必須であるが、ベータ細胞からのインスリン分泌は阻害していることが示唆されました。
これまでに、ベータ細胞では、SNAP23 よりも融合効率の高い類縁分子である SNAP25 がシンタキシン 1A、VAMP2と結合してインスリン分泌を促進することが知られており、SNAP23 がシンタキシン 1A、VAMP2 と結合してしまうことによって SNAP25 による開口放出を減少させていることが示唆されました(下図)。一方、腺房細胞では SNAP25 はほとんど発現していないため、SNAP23 が主に開口放出を担っていると考えられました。
さらに同グループは、膵臓で SNAP23 の作用を抑制することによってインスリン分泌を増加させることが可能ではないかと考え、理化学研究所との共同研究により、SNAP23 に結合する低分子化合物として MF286 を同定しました。MF286 は、マウスから取り出したベータ細胞において、インスリン分泌を増加させる効果が認められました。そのため、MF286 をマウス個体の腹腔内へ投与したところ、血中のインスリン濃度が増加し、血糖値の上昇が抑えられることがわかりました。このことから、MF286 がマウス個体内においてもインスリン分泌を増加させることが示唆されました。
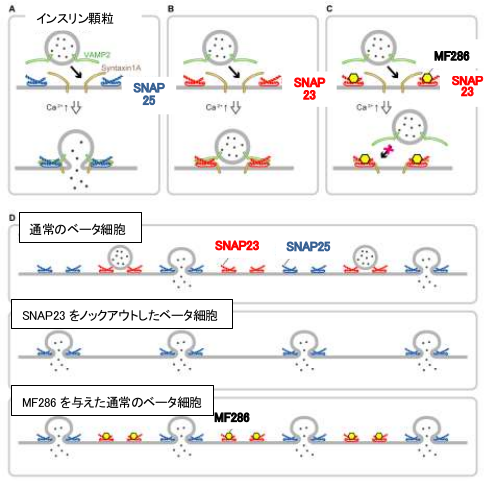
| A: | SNAP25-シンタキシン 1A-VAMP2 複合体はインスリン分泌を促進する。 |
| B: | SNAP23-シンタキシン 1A-VAMP2 複合体は融合効率が低く、分泌を阻害する。 |
| C: | MF286 は SNAP23-シンタキシン 1A-VAMP2 複合体の形成を阻害する。 |
| D: | SNAP23 遺伝子欠損マウスや MF286 処理により SNAP25-シンタキシン 1A-VAMP2 複合体が増加し、インスリン分泌が増加する。 |
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、膵臓のランゲルハンス島ベータ細胞において、MF286 が SNAP23 を抑制することでインスリン分泌が増加することが明らかとなり、今後、これまでの治療薬とは作用が異なる、SNAP23 を標的とした新しい糖尿病治療薬の開発につながる可能性が期待されます。また、MF286 は腺房細胞からのアミラーゼ分泌を抑制することも明らかとなったことで、異常な消化酵素の分泌による膵炎の症状を抑制する治療薬の開発にもつながる可能性があります。
特記事項
本研究成果は、2016年10月3日(月)22時(日本時間)に米国科学誌「The Journal of Cell Biology」(オンライン)に掲載されます。
| 【タイトル】 | "Opposing roles for SNAP23 in secretion in exocrine and endocrine pancreatic cells" |
| 【著者】 |
Masataka Kunii1,2, Mica Ohara-Imaizumi3, Noriko Takahashi4, Masaki Kobayashi5, Ryosuke Kawakami6, Yasumitsu Kondoh7, Takeshi Shimizu7, Siro Simizu8, Bangzhong Lin9, Kazuto Nunomura9 , Kyota Aoyagi3, Mitsuyo Ohno4, Masaki Ohmuraya10, Takashi Sato1, Shin-ichiro Yoshimura2, Ken Sato1, Reiko Harada2,11, Yoon-Jeong Kim9, Hiroyuki Osada7, Tomomi Nemoto6, Haruo Kasai4, Tadahiro Kitamura5, Shinya Nagamatsu3, and Akihiro Harada1,2,* *責任著者
|
なお、本研究は、主に科学研究費補助金基盤研究(B)および若手研究(B)の支援によって行われました。
用語説明
- ※1 SNAP23 (synaptosomal-associated protein 23)
- 主に細胞膜に局在する SNARE タンパク質※5の一つ。神経細胞や内分泌細胞に特異的に発現する SNAP25 と異なり、全身の様々な細胞に発現している。
- ※2 インスリン
- 膵臓ランゲルハンス島ベータ細胞から分泌されるホルモン。血糖値を低下させる作用がある。インスリンが不足すると、肝臓・筋肉・脂肪組織などの臓器でブドウ糖の利用や取り込みが低下し、血中のブドウ糖が増えて高血糖になるため、糖尿病になる。
- ※3 アミラーゼ
- 唾液腺や膵臓の腺房細胞から分泌される消化酵素の1種。デンプンなどの多糖類を加水分解する。
- ※4 開口放出
- 細胞内で作られた消化酵素やホルモンなどの分泌タンパク質は輸送小胞という袋に包まれて輸送され、細胞膜と融合することで細胞外へ分泌される。この分泌過程を開口放出といい、SNARE タンパク質 ※5 によって調節されている。
- ※5 SNARE(Soluble N -ethylmaleimide sensitive factor attachment protein receptor)タンパク質
- 細胞内膜輸送において小胞と細胞内小器官、細胞膜との融合を促進するタンパク質群。
本件に関する問い合わせ先
- <研究に関すること>
-
原田 彰宏(はらだ あきひろ)
大阪大学 大学院医学系研究科 細胞生物学 教授
TEL:06-6879-3210
FAX: 06-6879-3213
E-mail: aharada@acb.med.osaka-u.ac.jp - <報道に関すること>
これまで開口放出を促進すると考えられていた SNAP23 が、細胞種によっては逆に開口放出を阻害しているということには驚きました。更に我々がスクリーニングによって発見した SNAP23 に結合する低分子化合物にインスリン分泌を増加させる活性が見られたことから、この化合物は糖尿病の治療薬になりうる可能性があります。現在、糖尿病の治療で使用される薬剤には低血糖などの副作用が少なくありません。そのため、この化合物を改変することなどによって、より安全な治療薬が開発されることを期待します。










