ポイント
- 癌光治療用のミトコンドリア標的型ナノカプセルの開発に成功。
- 担癌モデルマウスを用いた治療効果の検証実験において,単回投与で癌細胞の成長を著しく抑制。
- ミトコンドリアを狙った薬剤耐性癌の新しい治療法の開発に期待。
概要
北海道大学電子科学研究所の高野勇太准教授と大学院薬学研究院の山田勇磨准教授,原島秀吉教授らの研究グループは,光増感分子 (Photosensitizer, PS)を搭載したミトコンドリア標的型ナノカプセルの構築に成功し,ヒト由来の癌を担持するマウスを用いた検証実験を行い,「ミトコンドリアを狙い撃ちする癌光治療戦略」の有用性を示すことに成功しました。
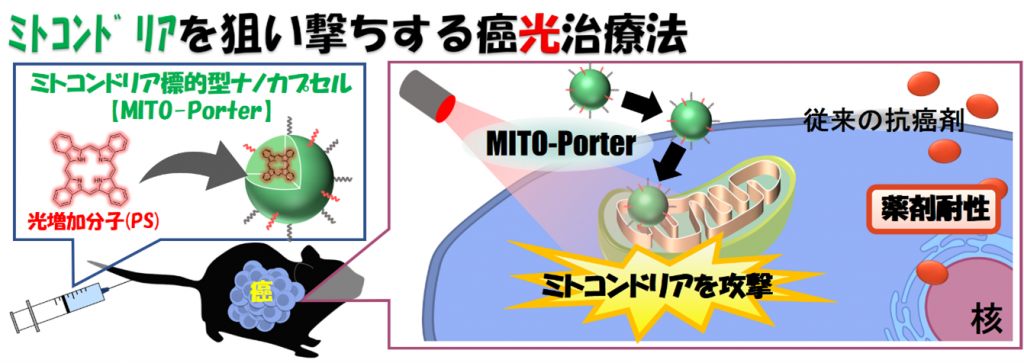
癌光治療は,患部切除を行わずに選択部位の癌組織を死滅させるため,患者の身体的負担が少ない治療法として期待されています。一方で,現状の光治療法では,殺しきれなかった癌細胞が増殖することによる耐性癌発生リスクがあり,それを解決する治療法の開発が望まれています。そこで研究グループは,癌細胞のエネルギー工場であるミトコンドリアを破壊する新たな癌光治療の検証を試みました。光照射によってミトコンドリア内で活性酸素発生を誘導するPS (rTPA, 特願2018-172698)を,ミトコンドリア型ナノカプセル (MITO-Porter, 特許第5067733号)を用い,ヒト舌癌細胞(SAS cell)のミトコンドリアへ送達しました。SAS cellを皮下移植した担癌モデルマウスを作成・評価した結果,MITO-Porter (rTPA)投与・光照射群において,癌の増殖を著しく抑制する治療効果を観察しました。
本研究で採用する「ミトコンドリアを狙い撃ちする癌治療戦略」は既存薬の抗癌作用機序と異なり,薬剤耐性癌の治療にも有用であると期待されます。また,癌細胞にピンポイントに抗癌剤を運ぶナノカプセルは正常細胞への侵襲性を抑えることが期待されるため,「効果がでているのに副作用で治療を断念」などの問題点の解決にもつながる可能性があります。さらに,多彩な機能を有するミトコンドリアを標的とした創薬開発の医療用ナノカプセルの基盤技術としても貢献できると期待されます。
本研究成果は,2021年8月21日(土)公開Nanoscale Advances誌に掲載されました。
【背景】
癌光治療は,患部切除を行わずに選択部位の癌組織を死滅させるため,患者の身体的負担が少ない治療法として期待されています。しかし現状の光治療法の原理では,殺しきれなかった癌細胞が増殖することによる耐性癌発生のリスク問題があり,それを解決する治療法の開発が望まれています。抗癌剤の多くは,癌細胞の遺伝子が保存されている「核」を攻撃して,癌細胞をやっつけます。核に抗癌剤が運ばれると細胞の部品(遺伝子に作り方が書かれている)を作る活動が停止するため,癌細胞の成長が止まります。しかし,薬剤耐性を獲得した癌をやっつけるためには,核以外を標的とする必要があります。
【研究手法】
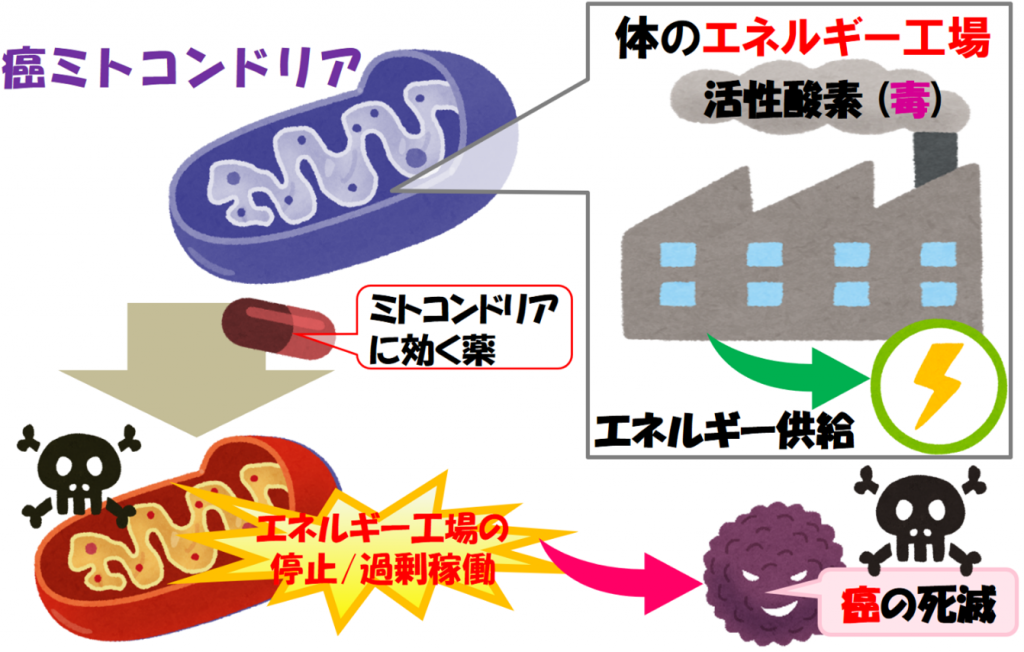
本研究は,癌細胞のエネルギー工場であるミトコンドリアを破壊する新たな癌光治療の検証を試みました(図1)。ミトコンドリアは,細胞のエネルギー工場ですので,癌細胞のミトコンドリアを破壊すれば,癌の活動はストップします【エネルギー工場の停止】。また,エネルギー工場であるミトコンドリアでは,細胞の毒にもなる活性酸素(工場の煙)が排出されています。そのため,活性酸素を増加させるような薬をミトコンドリアに運んで癌細胞を破壊する作戦もあります【エネルギー工場の過剰稼働】。『ミトコンドリアを狙い撃ちする癌治療』は,これまでの抗癌剤とは効き方が違うので,新しい治療の選択肢を提供する事ができると期待しています。私たちはこれまでに,ミトコンドリア標的型ナノカプセル(MITO-Porter)を利用して,薬剤耐性のある癌細胞のミトコンドリアに抗癌剤を運ぶ研究を進め,細胞実験で一定の成果を得ています (Yamada et al, J Pharm Sci 106: 2428-2437 (2017))。今回の研究では,光増感分子 (Photosensitizer, PS)を搭載したMITO-Porterを構築し,ヒト由来の癌を担持するマウスを用いた検証実験を行い,「ミトコンドリアを狙い撃ちする癌光治療戦略」の有用性を動物実験で実証することに挑戦しました。
【研究成果】
本研究では,PSとして近赤外 (700nm)の光照射によってミトコンドリア内で活性酸素発生反応を誘導し得るポルフィリン骨格を有する独自の新規化合物 (rTPA, 特願2018-172698)を選択しました。また,分子送達に関しては,私たちが開発したミトコンドリア標的型ナノカプセル,MITO-Porter (特許第5067733号)を用いました。ミトコンドリアにrTPAを運ぶために,rTPAを搭載したMITO-Porter (MITO-Porter (rTPA))の構築を検討し,ナノサイズの粒子を調製することに成功しました (粒子径: 100 – 200 nm, ζ電位: +30~40 mV)。
モデル癌細胞として使用したヒト舌癌細胞(SAS cell)に蛍光標識を施したrTPA-MITO-Porterを添加し,ナノカプセルの細胞内局在を蛍光顕微鏡で観察しました。その結果,rTPA-MITO-Porterがミトコンドリアに集積する様子が観察され,MITO-PorterによるrTPAのミトコンドリア送達が確認できました。一方で,陰性コントロールナノカプセル(ミトコンドリア標的能がない)を利用した場合には,ミトコンドリアへの集積は観察されませんでした。
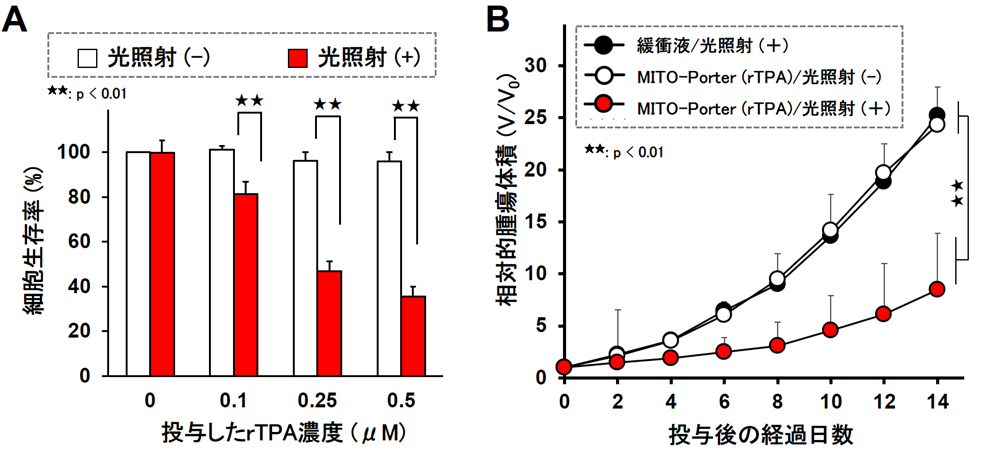
続いて,rTPA-MITO-PorterをSAS cellに添加し,光照射後にWST-1アッセイを用いて細胞生存率を算出し,癌治療効果を検証しました。図2Aのグラフでは,rTPA-MITO-Porter投与時の細胞生存率を縦軸に示しており,赤色の棒グラフで示す光を照射した群では,rTPA投与量に依存して細胞生存率が減少することを確認しました。一方で,光を照射しない場合(白色の棒グラフ)には細胞毒性は確認されませんでした。
SAS cellを皮下移植した担癌モデルマウスを作成し,MITO-Porter (rTPA)投与・光照射後の抗腫瘍効果を継時的に評価しました(図2B)。その結果,MITO-Porter (rTPA)投与・光照射群において,癌細胞の成長を著しく抑制する抗腫瘍効果を観察しました。これらの研究成果は,癌ミトコンドリアを標的とする癌光治療の有用性を示しております。
【今後への期待】
本研究で採用する「ミトコンドリアを狙い撃ちする癌治療戦略」は既存薬の抗癌作用機序と異なり,薬剤耐性癌の治療にも有用であると期待されます。また,癌細胞にピンポイントに抗癌剤を運ぶナノカプセルは正常細胞への侵襲性を抑えることが期待されるため,「効果がでているのに副作用で治療を断念」などの問題点の解決にもつながる可能性があります。さらに,多彩な機能を有するミトコンドリアを標的とした創薬開発の医療用ナノカプセルの基盤技術としても貢献できると期待されます。
【謝辞】
本研究は公益財団法人旭硝子財団(2018年度研究奨励),文部科学省科学研究費助成事業(JSPS科研費20H04523,20K21872),北海道大学創成特定研究事業,北海道大学機能強化促進事業(血管を標的とするナノ医療の実装)の支援を受けて実施されました。また,クラウドファンディング活動『副作用の少ない癌治療を,ミトコンドリアに薬を運ぶ技術開発で!』(https://readyfor.jp/projects/MITO-Porter)でお世話になった湘南アイパークならびにREADYFORの皆様に感謝申し上げます。最後に,私たちの研究の可能性を信じ,応援・ご支援して下さっている多くの皆様にこの場をお借りして心より御礼申し上げます。
論文情報
| 論文名 | The effective in vivo mitochondrial-targeting nanocarrier combined with a π-extended porphyrin-type photosensitizer(π拡張型ポルフィリン骨格光増感分子を搭載する生体適合性ミトコンドリア標的型ナノカプセル) |
| 著者名 | サトリアルジ1, 2,高野勇太3, 4,平田恵理5,牛島夏未5,原島秀吉1,山田勇磨1(1北海道大学大学院薬学研究院,2インドネシア・バンドン工科大学薬学部,3北海道大学電子科学研究所,4北海道大学大学院環境科学院,5北海道大学大学院歯学研究院) |
| 雑誌名 | Nanoscale Advances(ナノ科学研究の専門誌) |
| DOI | 10.1039/D1NA00427A |
| 公表日 | 2021年8月21日(土)(オンライン公開) |
お問い合わせ先
- 北海道大学電子科学研究所 准教授 高野勇太(たかのゆうた)
- TEL 011-706-9414
- FAX 011-706-9407
- メール tak[at]es.hokudai.ac.jp
- URL http://bijulab.main.jp/en/
配信元
- 北海道大学総務企画部広報課(〒060-0808 札幌市北区北8条西5丁目)
- TEL 011-706-2610
- FAX 011-706-2092
- メール jp-press[at]general.hokudai.ac.jp
【参考図】